Las baterías, el desarrollo tecnológico que cambió la vida moderna de la humanidad
Mitzi Daniela Moreno Islas, Giaan Arturo Álvarez Romero y Luis Humberto Mendoza Huizar
En la actualidad, el estilo de vida del ser humano sería inimaginable sin los dispositivos portátiles, cuyo desarrollo converge en su fuente de energía, es decir de su batería o pila (Figura 1). Este dispositivo, cuya función es el almacenamiento de electricidad, está íntimamente vinculado al desarrollo de la electroquímica, una rama muy importante de la ciencia que estudia las transformaciones entre la energía química y la energía eléctrica que combina propiedades tanto químicas como eléctricas.

Figura 1. Composición de una pila o batería común
Evidencia arqueológica ha demostrado la existencia de una batería primitiva del periodo de los partos, periodo conocido como helenístico porque tuvo un auge el arte y la ciencia en las grandes cuidades de Partia (entre 248 a. C. y 226 d. C.), a la cual le llamaron pila de Bagdad, la cual estaba compuesta por una vasija de cerámica, un tubo de cobre y una lámina de hierro, se especula que se utilizaba con fines medicinales. Décadas posteriores (año 1600), el científico inglés William Gilbert conocido como “padre del magnetismo” comenzó a idear métodos para reforzar el magnetismo en los imanes; durante el desarrollo de este estudio introdujo el término electricidad a partir de la palabra griega elektron (ámbar).
Un punto crucial en el estudio de la electricidad sucedió con Benjamín Franklin (año 1752), mundialmente conocido por su experimento con un cometa (Figura 2). El científico utilizó una cometa de seda que en la punta tenía una barra de hierro de la que descendía un cordel atado a una llave junto a una botella de Leyden (capaz de almacenar carga eléctrica). Al caer un rayo en la cometa, Franklin se dio cuenta que la botella de Leyden quedaba cargada de electricidad; este diseño se utilizaría después en todo el mundo para los pararrayos actuales que atraen la descarga eléctrica del rayo hacia la tierra.
Además de ese gran invento, Franklin también acuño el Principio de conservación de la electricidad, el cual enuncia que “la electricidad es un fluido único o fuego eléctrico que pasa de un cuerpo a otro en la descarga”.

Figura 2. Benjamín Franklin realizando su célebre experimento con una cometa durante una tormenta
A partir de estos experimentos, el método científico ha evolucionado hasta llegar al desarrollo de la electroquímica moderna. En 1800, Alessandro Giuseppe Antonio Anastasio Volta realizó experimentos que consistían en alternar discos de plata y de zinc, uno sobre otro, formando un cilindro de discos y así logró la demostración de lo que sería la primera batería electroquímica. Su aportación planteó las bases para conceptos tales como corrosión (oxidación de metales) o ánodos de sacrifico (componente de protección que se utiliza para proteger de la corrosión estructuras sumergidas en agua o enterradas). En honor a Volta, en el Sistema Internacional de Unidades existe el Volt, que es la unidad de la fuerza electromotriz o potencial eléctrico.

Figura 3. Batería electroquímica de Volta
Con las primeras ecuaciones propuestas por el francés André-Marie Ampere, donde describe la relación del campo magnético con la corriente eléctrica, George Ohm (año 1827), quien es considerado el Mozart de la electricidad, enunció la conocida Ley de Ohm donde se involucra el concepto de resistencia, es decir, la dificultad que tienen las cargas para fluir dentro del conductor. Más allá de esto, este principio describe por primera vez una clara relación proporcional entre la corriente eléctrica y el potencial eléctrico, e inversamente proporcional entra la corriente eléctrica y la resistencia.
En 1836, después de nueve años de la Ley de Ohm, John Frederic Daniell inventa la primera batería moderna (Figura 3a) que consistió en una barra de zinc sumergida en una solución de sulfato de zinc y otra barra de cobre sumergida en una disolución de sulfato de cobre. Las dos soluciones estaban separadas por una vasija de barro que no permitía que ambas se mezclaran, aunque sí permitía el paso de los iones a través de ella, actuando como lo que se conoce hoy en día como puente salino.
Como reemplazo de la pila de Daniell, inventada en 1836 por John Frederic Daniell, un químico británico y meteorólogo, Sir Williams Robert Grove, en 1839, desarrolló la pila de combustible, donde sustituye la barra de cobre en la pila de Daniell por una de platino (Figura 3b). Como sabemos, el platino es un metal costoso, por lo que Robert Wilhelm Eberhard Bunsen (1840) propuso que en lugar de usar platino se utilizara una barra de carbón (Figura 3c).
Más tarde, 33 años después para ser exactos (1873), Josías Latimer Clark crea la primera pila húmeda, es decir, donde utiliza una solución de electrolito dentro de la pila, y siguen usando zinc, entonces el principio es como en las pilas ya mencionadas, pero en este caso la barra de carbón es remplazada por mercurio (Figura 3d). La variación de Georges Leclanché, científico e ingeniero que usó carbono, hizo que la pila fuera de menor costo comparada con las anteriores.

4a)

4b)

4c)
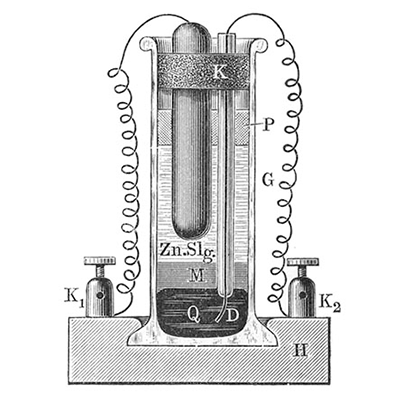
4d)
Figura 4. a) pila de Daniell; b) pila de Grove; c) pila de Bunsen y d) pila de Clark.
Un aspecto común en todas esas pilas era que, tanto en ánodo (donde se lleva a cabo la oxidación) como en cátodo (donde se lleva a cabo la reducción), usaban soluciones acuosas, lo que implicaba una importante limitación tecnológica. Carl Gassner vino a mejorar la pila de Leclanché construyendo la primera pila “seca” de la historia. En esta se encontraba una pasta de yeso de dióxido de manganeso en menor medio acuoso que en una pila “húmeda”; pero Glassner no había utilizado bien el termino hasta que Ludwig Mond y Charles Langer introdujeron el término “pila de combustible” y dieron solución a los problemas de las pilas pasadas.
James Drumm (1926-1931) comenzó su investigación sobre las pilas alcalinas de níquel-zinc y Thomas Bacon inventó la primera pila de combustible. En 1957, Karl Kordesch, Paul A. Marsal y Lewis Urry presentaron la patente para la batería alcalina (hidróxido de potasio como electrolito) de pila seca, que se convirtió en la batería Eveready Energizer de tamaño D.
En 1960 Stanley Whittingham, investigó con materiales superconductores y culminó en una batería de litio con un cátodo de disulfuro de titanio y un ánodo de litio metálico, pero era demasiado explosiva. Entonces John Goodenough (1980) indicó que el cátodo tendría un mayor potencial si estuviera hecho con un óxido metálico en lugar de un sulfuro metálico, y dando mejoras a estas dos propuestas Akira Yoshino crea la primera batería de iones litio comercial, comercializándose a nivel global para 1991. En 2019 a estos tres investigadores les otorgó el Premio Nobel de Química por el desarrollo de esta batería (Figura 5).

Figura 5. Batería de ion de litio
Hoy en día, las baterías de ion litio han marcado un parteaguas en el desarrollo tecnológico y científico. El desarrollo de nuevas baterías aún tiene su base en ellas, como las baterías de litio ferro-fosfato (LFP) descritas por primera vez en 1996 y comercializadas en autos eléctricos de nueva generación a partir de 2021 en los países orientales. Aunque algunos consideran que las baterías a base de aluminio serán las que reemplacen a las de litio, lo cierto es que el desarrollo de la vida del ser humano seguirá íntimamente relacionada a la evolución de estos dispositivos por muchas generaciones.
¿QUIÉN ES?
Mitzi Daniela Moreno Islas es licenciada en Química por la Universidad Autónoma del Estado de Hidalgo (UAEH). Actualmente realiza sus estudios de maestría en el Área Académica de Química del Instituto de Ciencias Básicas e Ingeniería (ICBI) en el área de diseño molecular asistido por computadora. Es becaria CONACYT por el Programa de Becas Nacionales.

Giaan Arturo Álvarez Romero es doctor en Química por la Universidad Autónoma Metropolitana. Actualmente es profesor de tiempo completo en la Universidad Autónoma del Estado de Hidalgo (UAEH), en el área Académica de Química del Instituto de Ciencias Básicas e Ingeniería (ICBI). Sus líneas de investigación son química de polímeros, química analítica y química de materiales. Es miembro del Sistema Nacional de Investigadores y profesor con Perfil deseable PRODEP.

Luis Humberto Mendoza Huizar es doctor en Química por la Universidad de Guanajuato. Actualmente es profesor investigador en la Universidad Autónoma del Estado de Hidalgo (UAEH), en el área académica de Química del Instituto de Ciencias Básicas e Ingeniería (ICBI). Sus líneas de investigación son electroquímica y diseño molecular asistido por computadora. Es miembro del Sistema Nacional de Investigadores y profesor con perfil deseable del Programa para el Desarrollo Profesional Docente, PRODEP.
